注射用硼替佐米
2025-12-25 10:22 点击:
【药品名称】
通用名称:注射用硼替佐米
英文名称:Bortezomib for Injection
汉语拼音:Zhusheyong Pengtizuomi
【成份】
活性成份:硼替佐米
化学名称:[(1R)-3-甲基-1-[[(2S)-1-氧-3-苯基-2-[(吡嗪羧基)氨基]丙基]氨基]丁基]硼酸
化学结构式:
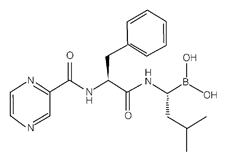
分子式:C19H25BN4O4
分子量:384.24
辅料:甘露醇、氮气
【性状】
本品为白色或类白色块状物或粉末。
【适应症】
多发性骨髓瘤
本品可联合美法仑和泼尼松(MP方案)用于既往未经治疗的且不适合大剂量化疗和骨髓移植的多发性骨髓瘤患者的治疗;或单药用于至少接受过一种或一种以上治疗后复发的多发性骨髓瘤患者的治疗。
套细胞淋巴瘤
本品可联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松,用于既往未经治疗的并且不适合接受造血干细胞移植的套细胞淋巴瘤成人患者;或用于复发或难治性套细胞淋巴瘤患者的治疗,患者在使用本品前至少接受过一种治疗。
【规格】
3.5mg
【用法用量】
本品可采用下列给药方法:
• 3-5秒静脉推注(浓度1 mg/mL),或者
• 皮下(浓度2.5 mg/mL)
由于每种给药途径的重溶浓度不同,因此计算给药体积时须仔细。
鞘内注射会导致死亡。
未经治疗的多发性骨髓瘤患者
本品在联合口服美法仑和口服泼尼松进行治疗时,每个疗程6周(如表1所示),共9个疗程。在第1~4疗程内,每周给予本品2次(第1、4、8、11、22、25、29和32天)。在第5~9疗程内,每周给予本品1次(第1、8、22和29天)。两次给药至少间隔72小时。
表1:未经治疗的多发性骨髓瘤患者的给药方案
| 每周给予本品2次 (第1~4个疗程) | |||||||||||||||||
| 周 | 1 | 2 | 3 | 4 | 5 | 6 | |||||||||||
|
本品 (1.3mg/m2) |
第1天 | -- | -- | 第4天 | 第8天 | 第11天 | 休息期 | 第22天 | 第25天 | 第29天 | 第32天 | 休息期 | |||||
|
美法仑 (9mg/m2) 泼尼松 (60mg/m2) |
第1天 | 第2天 | 第3天 | 第4天 | -- | -- | 休息期 | -- | -- | -- | -- | 休息期 | |||||
| 每周给予本品一次 (第5~9个疗程) | |||||||||||||||||
| 周 | 1 | 2 | 3 | 4 | 5 | 6 | |||||||||||
|
本品 (1.3mg/m2) |
第1天 | -- | -- | -- | 第8天 | 休息期 | 第22天 | 第29天 | 休息期 | ||||||||
|
美法仑 (9mg/m2) 泼尼松 (60mg/m2) |
第1天 | 第2天 | 第3天 | 第4天 | -- | 休息期 | -- | -- | 休息期 | ||||||||
本品与美法仑、泼尼松联合治疗的剂量调整
本品与美法仑、泼尼松联合治疗的任一疗程开始之前,患者应符合以下条件:
- 血小板计数应≥70×109/L ,ANC应≥1.0×109/L
- 非血液学毒性应降至1级或基线水平
| 毒性 | 剂量调整或延迟给药 |
疗程内的血液学毒性:
|
考虑在后一个疗程减少美法仑剂量的25%。 |
|
应停用本品。 |
|
应在后一疗程降低一个剂量水平(从1.3mg/m2降至1mg/m2,或者从1mg/m2降至0.7mg/m2)。 |
| 3级及以上的非血液学毒性 | 停用本品直至毒性症状减轻至1级或基线水平。然后,以降低一个剂量水平(从1.3mg/m2降至1mg/m2, 或从1mg/m2降至0.7mg/m2)重新开始本品治疗。对于与本品相关的神经性疼痛和/或周围神经病变,可根据表3所示暂停或调整本品的剂量。 |
复发的多发性骨髓瘤患者和复发的套细胞淋巴瘤患者
单药
治疗推荐剂量
本品的推荐剂量为单次注射1.3mg/m2,每周注射2次,连续注射2周(即在第1、4、8和11天注射)后停药10天(即从第12至第21天)。
3周为1个疗程,两次给药至少间隔72小时。
对于超过8个疗程的延续性治疗,可按标准方案给药。对于复发的多发性骨髓瘤患者,也可以按每周1次给药、连续给药4周的维持方案(第1、8、15和22天),随后是13天的休息期(第23至35天)。
剂量调整以及重新开始治疗
当发生任何3级非血液学毒性或任何4级血液学毒性(不包括下面讨论的神经病变)时,应暂停本品治疗。一旦毒性症状得到缓解,可以重新开始本品的治疗,剂量减少25%(例如:1.3mg/m2降低到1.0mg/m2;1.0mg/m2降低到0.7mg/m2)。如果患者发生与本品治疗有关的神经性疼痛或外周感觉神经病,建议按下表推荐的调整剂量进行治疗,主治医生应根据患者实际病情选择合适的剂量调整方案。有因严重自主神经病变导致中断或停止治疗的报告。如果患者本身患有严重的神经病变,只有权衡利弊后方可使用本品。
表3:当发生与本品治疗有关的神经性疼痛或者外周感觉或运动神经元病时推荐的剂量调整
| 周围神经病变症状和体征的严重程度* | 用法用量调整 |
| 1级(无症状;感觉异常或者深肌腱反射丧失),不伴有疼痛或者功能丧失 | 不改变 |
| 1级伴有疼痛或者2 级(中度症状;工具性日常活动(ADL)受限**) | 剂量降至1.0mg/m2或将本品的治疗方案改为 1.3mg/m2 每周1次 |
| 2级伴有疼痛或者3级(重度症状;自理性日常活动(ADL)受限 ***) | 暂停本品的治疗,直至毒性症状缓解后恢复本品的治疗,剂量降至 0.7mg/m2 ,每周注射1次。 |
| 4级(导致危及生命;出现需紧急干预的指征) | 停止本品的治疗。 |
|
* 根据NCI 常见毒性标准 CTCAE v 4.0分级; **工具性ADL:系指做饭、购买杂物或衣物、打电话、理财等; *** 自理性ADL:系指洗澡、穿衣和脱衣、自己吃饭、如厕、服药且无需卧床。 |
|
未经治疗的套细胞淋巴瘤患者
本品与利妥昔单抗、环磷酰胺、多柔比星和泼尼松联合用药的推荐剂量
本品剂量参见单药治疗部分。需治疗6个疗程,对于在第6个疗程首次记录缓解的患者,推荐再接受2个疗程的治疗。
3周为1个疗程,在每个疗程的第1天静脉输注以下药物:利妥昔单抗375 mg/m2、环磷酰胺750 mg/m2、多柔比星50 mg/m2。在每个疗程的第1、2、3、4和5天口服泼尼松100 mg/m2。
未经治疗的套细胞淋巴瘤患者在治疗期间的剂量调整
每个疗程的第1天之前(第一疗程除外):
- 血小板计数应≥100×109 /L且中性粒细胞绝对计数(ANC)应≥1.5×109 /L
- 血红蛋白应≥8g /dL(≥4.96 mmol /L)
- 非血液学毒性应已恢复到1级或基线水平
表 4:未经治疗的套细胞淋巴瘤患者在治疗期间的剂量调整
| 毒性 | 剂量调整或延迟给药 |
血液学毒性
|
应暂停本品治疗,最多停药2周,直至患者的ANC ≥ 0.75 ´ 109/L且血小板计数 ≥ 25 ´ 109/L。
应暂停本品治疗。 |
| ≥ 3级非血液学毒性 |
应暂停本品治疗,直至毒性症状消退至2级或更低水平。然后可降低一个剂量水平重新开始本品治疗(从1.3 mg/m2降低至1 mg/m2或从1 mg/m2降低至0.7 mg/m2)。 如果发生与本品相关的神经性疼痛和/或周围神经病变,应根据表3所述暂停和/或调整本品给药。 |
利妥昔单抗、环磷酰胺、多柔比星或泼尼松的有关信息请参见其说明书。
肝功能损伤患者
轻度肝功能损伤患者不需要调整起始剂量并应按推荐剂量治疗。中重度肝功能损伤患者使用本品的起始剂量应降为0.7mg/m2,根据患者第一个周期的耐受性,随后的治疗剂量增加至1.0mg/m2或进一步降至0.5mg/m2。
表5:肝功能损伤患者的推荐起始剂量调整表
| 胆红素水平 | SGOT (AST) 水平 | 起始剂量调整(单次1.3mg/m2,每周2次) | |
| 轻度 | £ 1.0x ULN | > ULN | 不变 |
| > 1.0x~1.5x ULN | 任何值 | 不变 | |
| 中度 | > 1.5x~3x ULN | 任何值 | 第一个治疗周期的剂量降至0.7mg/m2。根据患者的耐受性,随后的治疗剂量增加至1.0mg/m2或进一步降至0.5mg/m2。 |
| 重度 | > 3x ULN | 任何值 | |
|
缩写: SGOT = 血清谷草转氨酶 AST = 天冬氨酸氨基转移酶 ULN =正常值的上限 |
|||
本品的药代动力学不受患者肾功能损伤程度的影响,故肾功能损伤的患者无需调整本品的剂量。由于透析会降低本品的浓度,故应该在透析结束后再给予本品。
给药方法
本品采取静脉或皮下给药。静脉给药时,本品应通过外周或中心静脉内导管进行3-5秒静脉推注,之后使用0.9%氯化钠注射液进行冲洗。皮下给药时,应将重溶溶液注射到大腿(右侧或左侧)或腹部(右侧或左侧)。多次皮下注射时应轮换使用不同注射部位。
如果皮下注射本品之后发生局部注射部位反应的话,可采用较低浓度(用1 mg/mL替代2.5 mg/mL)的本品溶液进行皮下给药,或者转为静脉注射。
【药代动力学】
对11例多发性骨髓瘤患者静脉给予硼替佐米1.0mg/m2和1.3mg/m2后,首剂量(第1天)的最大血药浓度均值分别是57和112ng/mL。在随后的给药过程中,硼替佐米的最大血药浓度均值的范围是67 至106ng/mL (1.0mg/m2剂量组)和89至120ng/mL(1.3mg/m2剂量组)。多次给药后的硼替佐米的平均消除半衰期是40~193小时。与随后剂量相比,硼替佐米首次给药后的清除更快。首次给药1.0mg/m2和1.3mg/m2后的总体清除率均值分别为102和112L/h ,而1.0mg/m2和1.3mg/m2组随后剂量的总体清除率均值在15~32 L/h之间。
在III期试验的PK/PD研究中,多发性骨髓瘤患者在接受一次1.3mg/m2剂量的静脉给药或皮下给药(静注组n = 14,皮下给药组n = 17)后,两组多次给药后的全身暴露总量(AUClast)相当。皮下给药后的最大血药浓度(20.4ng/mL)低于静注 (223ng/mL)给药。AUClast几何均值之比为0.99,90%置信区间为80.18% ~ 122.80%。
分布
多发性骨髓瘤患者单次给药或多次给药1.0mg/m2 或1.3mg/m2硼替佐米后,患者体内的分布容积均值的范围是489~1884L/m2,这说明硼替佐米可广泛分布于外周组织。浓度为100~1000ng/mL时,硼替佐米与人体血浆蛋白的平均结合率为83%。
代谢
利用人体肝微粒体和互补脱氧核糖核酸(cDNA)表达的细胞色素P450同工酶进行的体外研究显示,硼替佐米主要通过细胞色素P450酶系的3A4、2C19和1A2酶氧化代谢,少量经2D6和2C9代谢。主要代谢途径是去硼酸化,形成2个去硼酸化代谢物,再通过羟基化形成几个代谢产物。去硼酸化的硼替佐米代谢产物无抑制26S蛋白酶体的活性。8名患者静脉给药后10分钟和30分钟的血浆数据显示,血浆中代谢产物的浓度比原型药物低。
消除
尚未对硼替佐米在人体内的消除途径进行研究。
年龄、性别和人种
104名儿童患者(2~16岁)每周2次静脉推注1.3mg/m2硼替佐米后数据也用于分析硼替佐米药代动力学特征。群体药代动力学分析显示,硼替佐米清除率随着体表面积增加而增加。清除率几何平均值(%CV)为7.79(25%)L/hr/m2,稳态分布体积为834(39%)L/m2,消除半衰期为100(44%)小时。经过体表面积校正后,其他人口统计数据,如年龄、体重和性别,对硼替佐米清除率不产生具有临床意义的影响。观察到儿童患者经体表面校正后的硼替佐米清除率与成人相似。
尚未评价性别和人种对硼替佐米药动学的影响。
肝功能损伤的患者
评价了60例癌症伴肝功能损伤患者对硼替佐米药代动力学的影响,试验中硼替佐米剂量范围从0.5到1.3mg/m2。与肝功能正常的患者相比,轻度肝功能损伤不会改变硼替佐米剂量归一化后的AUC。但在中度或重度肝功能损伤患者中硼替佐米剂量归一化后的AUC均值会增加约60%。建议中度或重度肝功能损伤的患者使用硼替佐米时降低起始剂量,同时应进行严密的监测。
肾功能损伤的患者
在一项药代动力学研究中,不同程度的肾功能损伤患者按肌酐清除率(CrCL)分组:正常 (CrCL ≥60 mL/分钟/1.73 m2,n=12),轻度 (CrCL=40~59 mL/分钟/1.73 m2,n=10),中度 (CrCL=20~39 mL/分钟/1.73 m2,n=9)和重度 (CrCL < 20 mL/分钟/1.73 m2,n=3)。本研究包括需透析且在透析结束后再给予硼替佐米的患者8例。 硼替佐米静脉给药的剂量为0.7~1.3 mg/m2, 每周2次。硼替佐米的暴露量(剂量归一化的AUC 和最大血药浓度)在以上各组中相当。
【贮 藏】
避光,不超过30℃保存。
【执行标准】
【批准文号】
【上市许可持有人】
名称:海南双成药业股份有限公司
注册地址:海口市秀英区兴国路16号
邮政编码:570314
电话号码:0898-68510103、68561220
传真号码:0898-68512597
网址:http://www.shuangchengmed.com
【生产企业】
企业名称:宁波双成药业有限公司
生产地址:浙江省宁波市杭州湾新区滨海四路866号
邮政编码:315336
电话号码:0574-63982000
传真号码:0574-63339621
【使用介绍】
本品不含抗菌性防腐剂。配制后的溶液应在25ºC下保存,配后8小时内使用。配制后的溶液放在原容器或注射器内不得超过8小时,且不应在室内光线下暴露8小时以上。
未拆封的本品应在30ºC以下保存,勿拆原避光包装。
操作注意事项
本品为抗肿瘤药物,所以处理和制备时应谨慎,应采取适当的无菌操作。推荐配制时戴手套且穿防护服以避免皮肤接触。临床试验中,有5%的患者报告出现局部皮肤刺激,但未发生组织损伤。
硼替佐米曾有因不慎的鞘内注射而致死亡的病例报告。因此,本品仅用于静脉和皮下给药,严禁鞘内注射。
静脉和皮下给药时的重溶/配置
按照下表,使用0.9%氯化钠溶液溶解本品。配制后的溶液应为澄清、透明。在溶液和容器允许的情况下,此类药品使用前均需目视观察溶液颜色和微粒物。若观察到溶液颜色变化或出现颗粒物,不应使用本品。
| 静脉给药 | 皮下给药 | |||
| 3.5mg本品 | 3.5mg本品 | |||
| 溶解本品(每瓶)的溶液(0.9%氯化钠溶液)体积 | 3.5mL | 1.4 mL | ||
| 配制后最终浓度 (mg/mL) | 1.0mg/mL | 2.5mg/mL | ||